
近日,复旦大学上海医学院医学分子病毒学教育部/卫健委重点实验室陈捷亮/袁正宏团队以“An Extracellular Humanized IFNAR Immunocompetent Mouse Model for Analyses of Human Interferon Alpha and Subtypes”为题,在Emerging Microbes & Infections期刊发表了关于人类干扰素及亚型的最新研究成果(doi.org/10.1080/22221751.2023.2287681)。该研究构建了一种可高效应答人类I型干扰素(IFN-I)且免疫健全的小鼠模型,这为解析人类干扰素及亚型抗病毒和免疫调节的功能机制及干扰素类药物的临床前评价提供了有力工具。
IFN是一类具有多重生物学功能的多基因家族细胞因子,在机体抗病毒及肿瘤免疫中发挥有重要作用。根据IFN所结合受体不同,已鉴定的人类IFN有I、II和III型三型,其中I型IFN进一步包含多种亚型(迄今已发现近二十种)。目前临床应用的主要为早期鉴定发现的IFN-α2,广泛用于慢性乙肝和部分肿瘤的治疗,但存在应答低和副作用大等问题。团队前期采用体外细胞模型和免疫缺陷人源嵌合鼠,在13种人类IFN-α亚型中研究发现,α14亚型相较α2具有更强的抗病毒效果。然而,由于人和小鼠在IFN受体上存在显著种属差异,尚缺乏能有效应答人类IFN且免疫健全的小鼠模型用于人IFN-I亚型的体内研究。
鉴于此,团队通过二次打靶策略,利用鼠源I型干扰素受体(IFNAR1/2)调控序列及信号肽区域,形成人源hIFNAR胞外段和鼠源mIFNAR跨膜及胞内段的嵌合受体(IFNAR-hEC),完整保留了嵌合IFN受体的组织分布特异性,杂合和纯合IFNAR-hEC小鼠均表现出对人类IFN-I的良好应答。进一步利用LCMV急性感染模型,验证杂合IFNAR-hEC小鼠的内源性IFN应答和抗病毒系统保持完整,提示该模型在抗病毒和免疫调节功能评价方面的普适性。
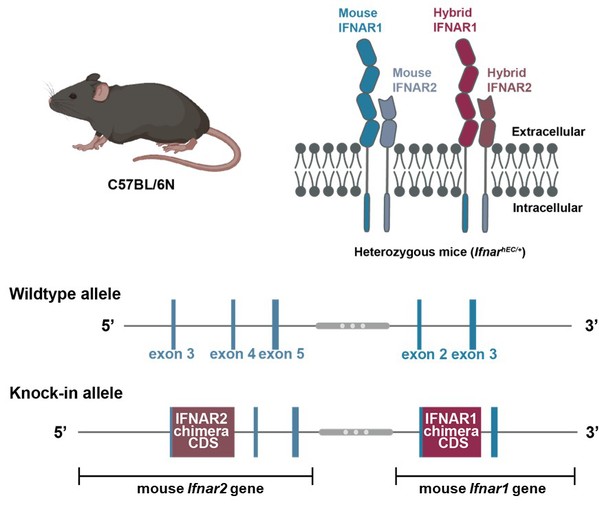
图1. IFNAR-hEC小鼠模型的构建策略
利用IFNAR-hEC小鼠及其分离的细胞,团队确认了其对13种人类IFN-α亚型的应答与人类细胞中的激活谱式相似,进而重点比较研究了IFN-α2和α14两种亚型在激活下游IFN-I信号通路和免疫调节方面的差异。结果证实,IFN-α14可诱生更高水平的STAT1/2磷酸化及干扰素刺激基因(ISG),尤其可协同激活I型和II型IFN信号通路,同时更高水平活化抗原特异性CD8+ T细胞。进一步在IFNAR-hEC小鼠的乙肝病毒(HBV)复制模型中,团队评估了临床所用的长效化PEG-IFN-α2的抗病毒效果。结果显示其可实现HBV DNA、RNA 及抗原水平的广泛抑制,但仅在个别小鼠中观察到乙肝表面抗原抗体的产生。团队正进一步应用此模型深入研发具有更高效抗病毒和免疫调节功效的人IFN亚型。
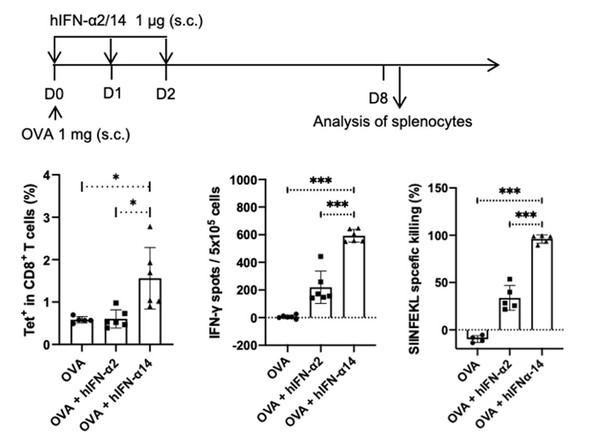
图2. IFN-α14较IFN-α2更高水平活化OVA特异性CD8+ T细胞
综上,该研究设计构建了一种能模拟人干扰素应答且免疫健全的小鼠模型,其可有效反映人类各IFN-I亚型的功能及型间差异。这为系统解析IFN的天然免疫和免疫调节效应的功能和机制提供了重要平台,有助于推动对人IFN多样性的生物学理解,促进基于IFN功能特性的新型策略研发,为乙肝治愈等疾病的干预研究提供理论技术支撑。
该研究得到了国家重点研发计划课题、国家自然科学基金项目和中国医学科学院项目等资助,复旦大学陈捷亮研究员和袁正宏教授为论文的共同通讯作者,博士生李雨檬和阿说阿沙为共同第一作者,核心成果已申报发明专利。





